Auteur:
Christy White
Date De Création:
8 Peut 2021
Date De Mise À Jour:
1 Juillet 2024
Contenu
- Avancer d'un pas
- Méthode 1 sur 3: Première partie: Comprendre les coquilles d'électrons
- Méthode 2 sur 3: Deuxième partie: Recherche d'électrons de valence dans les métaux, sauf les métaux de transition
- Méthode 3 sur 3: Troisième partie: Recherche d'électrons de valence dans les métaux de transition
- Conseils
- Nécessités
Les électrons de Valence se trouvent dans la coque externe d'un élément. Le nombre d'électrons de valence dans un atome détermine le type de liaison chimique que cet élément peut former. La meilleure façon de connaître le nombre d'électrons de valence est d'utiliser le tableau périodique des éléments.
Avancer d'un pas
Méthode 1 sur 3: Première partie: Comprendre les coquilles d'électrons
 Le tableau périodique des éléments. Il s'agit d'un tableau avec des codes de couleur, où dans chaque cellule un élément est affiché avec le numéro atomique et 1 à 3 lettres comme symbole.
Le tableau périodique des éléments. Il s'agit d'un tableau avec des codes de couleur, où dans chaque cellule un élément est affiché avec le numéro atomique et 1 à 3 lettres comme symbole.  Trouvez le numéro atomique de l'élément. Le numéro atomique est au-dessus ou à côté du symbole de l'élément. Par exemple: le bore (B) a un numéro atomique de 5, ce qui signifie qu'il a 5 protons et 5 électrons.
Trouvez le numéro atomique de l'élément. Le numéro atomique est au-dessus ou à côté du symbole de l'élément. Par exemple: le bore (B) a un numéro atomique de 5, ce qui signifie qu'il a 5 protons et 5 électrons.  Dessinez une représentation simple d'un atome et placez les électrons en orbite autour du noyau. Ces emplois sont également appelés coquilles ou niveaux d'énergie. Le nombre maximum d'électrons qui peuvent être dans la même coquille est fixe, et les coquilles sont remplies de l'orbite interne à l'orbite externe.
Dessinez une représentation simple d'un atome et placez les électrons en orbite autour du noyau. Ces emplois sont également appelés coquilles ou niveaux d'énergie. Le nombre maximum d'électrons qui peuvent être dans la même coquille est fixe, et les coquilles sont remplies de l'orbite interne à l'orbite externe. - Coquille K (interne): 2 électrons maximum.
- L Shell: 8 électrons maximum.
- M Shell: 18 électrons maximum.
- N Shell: 32 électrons maximum.
- O Shell: 50 électrons maximum.
- P Shell (externe): 72 électrons maximum.
 Trouvez le nombre d'électrons dans la coque extérieure. Ce sont les électrons de valence.
Trouvez le nombre d'électrons dans la coque extérieure. Ce sont les électrons de valence. - Lorsque la coque de valence est pleine, l'élément est stable.
- Si la coquille de valence n'est pas pleine, l'élément est réactif, ce qui signifie qu'il peut se lier chimiquement à l'atome d'un autre élément. Chaque atome partage ses électrons de valence pour tenter de remplir la couche de valence.
Méthode 2 sur 3: Deuxième partie: Recherche d'électrons de valence dans les métaux, sauf les métaux de transition
 Numérotez chaque colonne du tableau périodique, de 1 à 18. L'hydrogène (H) est en haut de la colonne 1 et l'hélium (He) en haut de la colonne 18. Ce sont les différents groupes d'éléments.
Numérotez chaque colonne du tableau périodique, de 1 à 18. L'hydrogène (H) est en haut de la colonne 1 et l'hélium (He) en haut de la colonne 18. Ce sont les différents groupes d'éléments.  Donnez à chaque ligne un numéro, de 1 à 7. Ce sont les périodes des éléments, et elles correspondent au nombre de coquilles ou aux niveaux d'énergie d'un atome.
Donnez à chaque ligne un numéro, de 1 à 7. Ce sont les périodes des éléments, et elles correspondent au nombre de coquilles ou aux niveaux d'énergie d'un atome. - L'hydrogène (H) et l'hélium (He) ont tous deux 1 coquille, tandis que le Francium (Fr) en a 7.
- Les lanthanides et actinides sont regroupés et listés sous le tableau principal. Tous les lanthanides appartiennent à la période 6, groupe 3 et tous les actinides appartiennent à la période 7, groupe 3.
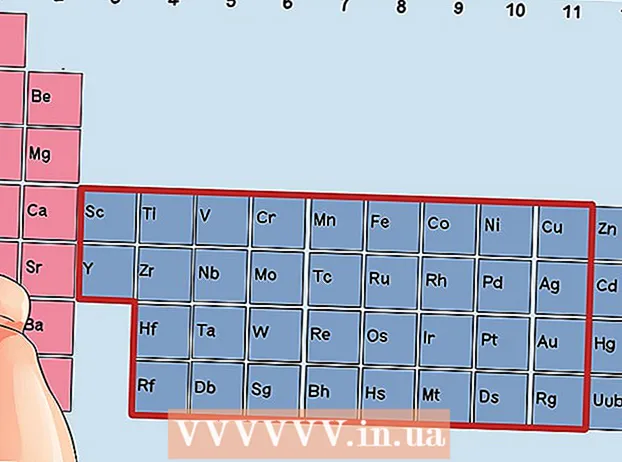
 Localisez un élément qui n'est pas un métal de transition. Les métaux de transition sont dans les groupes 3 à 12. Les numéros de groupe des autres métaux indiquent le nombre d'électrons de valence.
Localisez un élément qui n'est pas un métal de transition. Les métaux de transition sont dans les groupes 3 à 12. Les numéros de groupe des autres métaux indiquent le nombre d'électrons de valence. - Groupe 1: 1 électron de valence
- Groupe 2: 2 électrons de valence
- Groupe 13: 3 électrons de valence
- Groupe 14: 4 électrons de valence
- Groupe 15: 5 électrons de valence
- Groupe 16: 6 électrons de valence
- Groupe 17: 7 électrons de valence
- Groupe 18: 8 électrons de valence - sauf l'hélium, qui en a 2
Méthode 3 sur 3: Troisième partie: Recherche d'électrons de valence dans les métaux de transition
 Trouvez un élément des groupes 3 à 12, les métaux de transition.
Trouvez un élément des groupes 3 à 12, les métaux de transition. Déterminez le nombre d'électrons de valence en fonction du numéro de groupe. Ces numéros de groupe correspondent à un nombre possible d'électrons de valence.
Déterminez le nombre d'électrons de valence en fonction du numéro de groupe. Ces numéros de groupe correspondent à un nombre possible d'électrons de valence. - Groupe 3: 3 électrons de valence
- Groupe 4: 2 à 4 électrons de valence
- Groupe 5: 2 à 5 électrons de valence
- Groupe 6: 2 à 6 électrons de valence
- Groupe 7: 2 à 7 électrons de valence
- Groupe 8: 2 ou 3 électrons de valence
- Groupe 9: 2 ou 3 électrons de valence
- Groupe 10: 2 ou 3 électrons de valence
- Groupe 11: 1 ou 2 électrons de valence
- Groupe 12: 2 électrons de valence
Conseils
- Les métaux de transition peuvent avoir des coques de valence qui ne sont pas complètement pleines. La détermination du nombre exact d'électrons de valence dans les métaux de transition nécessite certains principes de la théorie quantique qui sortent du cadre de cet article.
Nécessités
- Tableau périodique des éléments
- Crayon
- Papier



