Auteur:
Randy Alexander
Date De Création:
25 Avril 2021
Date De Mise À Jour:
26 Juin 2024
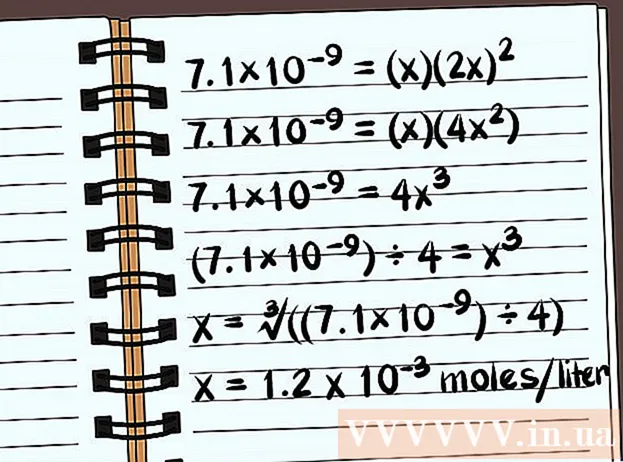
Contenu
En chimie, la solubilité est utilisée pour décrire les propriétés d'un composé solide lorsqu'il est complètement dissous dans un liquide sans laisser de résidu insoluble. Seuls les composés ioniques (chargés) sont solubles. En fait, il suffit de mémoriser quelques principes ou de consulter la littérature pour savoir si un composé ionique restera solide lorsqu'il est ajouté à l'eau ou si une grande quantité se dissout. En fait, une certaine quantité de molécules se dissoudra même si vous ne voyez aucun changement, donc pour que l'expérience soit précise, vous devez savoir comment calculer cette quantité de soluté.
Pas
Méthode 1 sur 2: utiliser des règles rapides
Renseignez-vous sur les composés ioniques. Chaque atome a généralement un certain nombre d'électrons, mais parfois il obtient ou cède un électron. Ce processus en fait un les ions accusé. Lorsqu'un ion avec une charge négative (excès d'un électron) rencontre un ion avec une charge positive (il manque un électron), ils se lieront comme la cathode et l'anode de deux aimants. Le résultat forme un composé ionique.
- Les ions ont une charge négative appelée anions, et les ions ont une charge positive appelée cation.
- Normalement, le nombre d'électrons dans un atome est égal au nombre de protons, il n'a donc pas de charge.

Comprenez la solubilité. Molécule d'eau (H2O) a une structure irrégulière et ressemble donc à un aimant: une extrémité a une charge positive et l'autre une charge négative. Lorsque vous mettez un composé ionique dans l'eau, ces «aimants» d'eau se rassemblent autour de lui, essayant de séparer les ions positifs et négatifs.- Certains composés ioniques ne sont pas très fortement absorbés, ils sont considérés soluble Parce qu'il se divise et se dissout lorsqu'il est ajouté à l'eau. D'autres composés ont des liaisons plus fortes insoluble parce que les ions sont étroitement attirés les uns vers les autres indépendamment de l'attraction de la molécule d'eau.
- Certains composés ont une force de liaison équivalente à l'attraction d'une molécule d'eau. Ils sont considérés légèrement soluble parce que la plupart des composés seront séparés, mais le reste sera toujours attiré les uns par les autres.

Comprenez le principe de la dissolution. Parce que les interactions entre les atomes sont si complexes, vous ne pouvez pas vous fier entièrement à l'intuition pour distinguer quels composés peuvent ou ne peuvent pas. Recherchez le premier ion du composé dans la liste ci-dessous pour ses propriétés communes, puis recherchez les exceptions pour vous assurer que le deuxième ion n'interagit pas anormalement avec lui.- Par exemple, pour vérifier le chlorure de strontium (SrCl2), veuillez rechercher Sr ou Cl dans les étapes en gras ci-dessous. Cl est "généralement soluble", alors vérifiez les exceptions en dessous. Sr n'est pas dans la liste des exceptions donc SrCl2 doit être soluble.
- Les exceptions les plus courantes à chaque règle sont écrites sous la règle. Il existe d'autres exceptions, mais il est peu probable que celles-ci se produisent pendant les heures normales de chimie ou de laboratoire.

Les composés sont solubles lorsqu'ils contiennent des métaux alcalins tels que Li, Na, K, Rb et Cs. Ces métaux sont également appelés éléments du groupe IA: lithium, sodium, potassium, rubidium et césium. Presque tous les composés contenant l'un de ces ions sont solubles.- Exception: Li3PO4 indissoluble.
PAS de composés3, C2H3O2, NON2, ClO3 et ClO4 sont tous solubles. Les noms correspondant aux ions ci-dessus sont nitrate, acétate, nitrite, chlorate et perchlorate. Notez que l'acétate est souvent abrégé en OAc.
- Exception: Ag (OAc) (acétate d'argent) et Hg (OAc)2 (acétate de mercure) insoluble.
- AgNO2 et KClO4 seulement "légèrement fondu".
Les composés de Cl, Br et I sont généralement solubles. Les ions chlorure, bromure et iodure forment presque toujours des composés solubles, appelés sels halogènes.
- Exception: Si l'un des ions ci-dessus se combine avec les ions argent Ag, mercure Hg2, ou plomb Pb, formera des composés insolubles. Il en va de même pour les composés moins courants formés lorsqu'ils sont combinés avec le cuivre Cu et le thali Tl.
Composés contenant du SO4 généralement soluble. Les ions sulfates forment souvent des composés solubles, mais il existe de nombreuses exceptions.
- Exception: Les ions sulfates forment un composé insoluble avec les ions suivants: strontium Sr, baryum Ba, plomb Pb, argent Ag, calcium Ca, radium Ra et argent monatom Ag2. Notez que le sulfate d'argent et le sulfate de calcium ne sont que modérément solubles, de sorte que certaines personnes les considèrent comme légèrement solubles.
Les substances contenant OH ou S sont insolubles. Les noms correspondants pour ces ions sont les hydroxydes et les sulfures.
- Exception: Vous souvenez-vous des métaux alcalins (groupes I-A) et comment ils aiment former des composés solubles? Li, Na, K, Rb et Cs forment tous des composés solubles avec les ions hydroxyde ou sulfure. De plus, les hydroxydes forment des sels solubles avec les ions de métaux alcalino-terreux (groupe II-A): calcium Ca, strontium Sr et baryum Ba. Remarque: les composés constitués d'hydroxydes et de métaux alcalino-terreux possèdent en effet un nombre important de molécules qui restent liées entre elles, ils sont donc parfois considérés comme «légèrement solubles».
Composés contenant du CO3 ou PO4 indissoluble. Vérifiez une dernière fois les ions carbonate et phosphate, et vous verrez si votre composé est soluble.
- Exception: Ces ions forment des composés solubles avec les métaux alcalins tels que Li, Na, K, Rb et Cs, ainsi qu'avec l'ion ammonium NH4.
Méthode 2 sur 2: Calculez la solubilité à partir de la constante Ksp
Rechercher la constante K du produit de solubilitésp. Cette constante est différente pour chaque composé, vous devez donc la rechercher sur un graphique dans un manuel ou en ligne. Étant donné que ces valeurs sont déterminées expérimentalement et peuvent varier considérablement d'un graphique à l'autre, il est préférable d'utiliser le graphique du manuel s'il est disponible. Sauf indication contraire, la plupart des graphiques supposent une température d'essai de 25 ° C.
- Par exemple, disons que vous dissolvez de l'iodure de plomb avec la formule PbI2, écrivez sa constante de produit de solubilité. Si vous vous référez au graphique bilbo.chm.uri.edu, vous utilisez la constante 7,1 × 10.
Écrivez une équation chimique. Le premier, déterminer le modèle de séparation ionique de ce composé lorsqu'il est dissous. Puis écrivez l'équation avec Ksp d'un côté et les ions composants de l'autre côté.
- Par exemple, une molécule PbI2 se dissocier en ions Pb, I et I. (Il suffit de connaître ou de vérifier la charge d'un ion, car tous les composés sont toujours électriquement neutres).
- Écris l'équation 7,1 × 10 =
- Cette équation est la constante de solubilité, vous pouvez trouver 2 ions dans le tableau de solubilité. Puisqu'il y a 2 ions l-, l- doit être quadratique.
Transformez les équations pour utiliser des variables. Réécrivez l'équation en utilisant des méthodes algébriques normales, en utilisant les informations que vous connaissez sur le nombre de molécules et d'ions. Définissez x égal à la masse du composé à dissoudre et réécrivez l'équation où x représente le nombre de chaque ion.
- Dans cet exemple, nous devons réécrire l'équation 7,1 × 10 =
- Puisqu'il n'y a qu'un seul ion plomb (Pb) dans le composé, le nombre de molécules dissoutes est égal au nombre d'ions plomb libres. Par conséquent, nous pouvons le définir sur x.
- Puisqu'il y a deux ions iode (I) pour chaque ion plomb, nous fixons le nombre d'atomes d'iode égal à 2x.
- Maintenant, l'équation devient 7,1 × 10 = (x) (2x)
Tenez compte des ions communs, le cas échéant. Sautez cette étape si vous dissolvez le composé dans de l'eau distillée. Si un composé est dissous dans une solution qui a déjà un ou plusieurs ions composants («ions communs»), la solubilité du composé diminuera considérablement. L'effet des ions généraux sera le plus évident sur les composés presque insolubles, et dans ce cas, vous pouvez supposer que la plupart des ions à l'équilibre sont ceux qui étaient auparavant en solution. Réécrivez l'équation pour calculer la concentration molaire (mol par litre ou M) des ions déjà dans la solution, en remplaçant cette valeur par la variable x que vous utilisez pour cet ion.
- Par exemple, si le composé d'iodure de plomb est dissous dans une solution de chlorure de plomb 0,2 M (PbCl)2), nous réécrirons l'équation comme 7,1 × 10 = (0,2M + x) (2x). Puisque 0,2 M est une concentration plus élevée que x, nous pourrions la réécrire en 7,1 × 10 = (0,2 M) (2x).
Résous l'équation. Résolvez pour x et vous verrez la solubilité du composé. Dans la définition de la constante de solubilité, vous devez écrire votre réponse en termes de nombre de moles du composé dissous par litre d'eau. Vous devrez peut-être utiliser votre ordinateur pour trouver la réponse finale.
- L'exemple suivant est la solubilité dans l'eau distillée sans aucun ion commun.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 moles par litre se dissoudront. C'est une très petite masse, donc ce composé est presque insoluble.
De quoi as-tu besoin
- Tableau des constantes de produit de solubilité du composé (Ksp)
Conseil
- Si vous disposez de données expérimentales sur la quantité de composés dissous, vous pouvez utiliser la même équation pour résoudre la constante de solubilité K.sp.
avertissement
- Il n'y a pas de consensus sur les définitions de ces termes, mais les chimistes s'accordent sur la majorité des composés. Un certain nombre de composés spéciaux dans lesquels des molécules solubles et insolubles constituent des constituants importants, chacun avec une description différente de ces composés.
- Quelques vieux manuels voir NH4OH est un composé soluble. Ce n'est pas vrai; De petites quantités d'ions NH ont été détectées4 et OH mais ces deux ions ne peuvent pas se combiner en composés.



