Auteur:
Charles Brown
Date De Création:
2 Février 2021
Date De Mise À Jour:
28 Juin 2024

Contenu
- Avancer d'un pas
- Méthode 1 sur 3: liaisons ioniques basiques
- Méthode 2 sur 3: métaux de transition
- Méthode 3 sur 3: Liaisons avec des ions polyatomiques
- Conseils
Les liaisons ioniques sont constituées de cations (ions positifs) et d'anions (ions négatifs). Les liaisons ioniques sont généralement constituées d'un métal et d'un ou plusieurs non-métaux. Pour nommer une liaison ionique, il vous suffit de trouver le nom du cation et de l'anion présents dans le composé. Vous devez d'abord écrire le nom du métal, suivi du nom du non-métal avec sa nouvelle terminaison correspondante. Si vous voulez savoir comment nommer les liaisons ioniques dans diverses situations, suivez simplement ces étapes.
Avancer d'un pas
Méthode 1 sur 3: liaisons ioniques basiques
 Notez la formule de liaison ionique. Disons le lien ionique sur lequel vous travaillez NaCl est.
Notez la formule de liaison ionique. Disons le lien ionique sur lequel vous travaillez NaCl est.  Notez le nom du métal ou du cation. C'est l'ion chargé positivement dans la liaison et il est toujours écrit en premier dans une formule de liaison ionique. Après est le sodium. Alors écris Sodium au.
Notez le nom du métal ou du cation. C'est l'ion chargé positivement dans la liaison et il est toujours écrit en premier dans une formule de liaison ionique. Après est le sodium. Alors écris Sodium au.  Écrivez le nom du non-métal, ou de l'anion, avec la terminaison «-ide».Cl est le chlore (chlore). Pour ajouter la terminaison "ide", remplacez simplement la dernière syllabe "-ine" par "-ide". Devient chlore chlorure.
Écrivez le nom du non-métal, ou de l'anion, avec la terminaison «-ide».Cl est le chlore (chlore). Pour ajouter la terminaison "ide", remplacez simplement la dernière syllabe "-ine" par "-ide". Devient chlore chlorure.  Combinez les noms. NaCl peut être écrit comme chlorure de sodium.
Combinez les noms. NaCl peut être écrit comme chlorure de sodium.  Entraînez-vous à nommer des liaisons ioniques simples. Une fois que vous avez réussi cette formule, essayez de nommer des liaisons ioniques plus simples. Même en mémoriser quelques-unes peut vous aider à mieux comprendre comment nommer les liaisons ioniques. En voici d'autres:
Entraînez-vous à nommer des liaisons ioniques simples. Une fois que vous avez réussi cette formule, essayez de nommer des liaisons ioniques plus simples. Même en mémoriser quelques-unes peut vous aider à mieux comprendre comment nommer les liaisons ioniques. En voici d'autres: - Li2S = Sulfure de lithium

- Ag2S = Sulfure d'argent

- MgCl2 = Chlorure de magnesium

- Li2S = Sulfure de lithium
Méthode 2 sur 3: métaux de transition
 Notez la formule de liaison ionique. Les métaux de transition se trouvent au centre du tableau périodique. Ils ont obtenu leur nom parce que leurs nombres d'oxydation, ou leurs charges, changent constamment. Disons que vous travaillez avec ce lien: Fe2O3.
Notez la formule de liaison ionique. Les métaux de transition se trouvent au centre du tableau périodique. Ils ont obtenu leur nom parce que leurs nombres d'oxydation, ou leurs charges, changent constamment. Disons que vous travaillez avec ce lien: Fe2O3.  Notez la charge du métal. Vous savez que le métal aura une charge positive afin que vous puissiez obtenir les 3 O3 biffer et noter ça Fe a une charge de +3. (Vous pouvez, pour le plaisir, faire l'inverse et l'écrire O a une charge de -2.) Parfois, la charge sera indiquée.
Notez la charge du métal. Vous savez que le métal aura une charge positive afin que vous puissiez obtenir les 3 O3 biffer et noter ça Fe a une charge de +3. (Vous pouvez, pour le plaisir, faire l'inverse et l'écrire O a une charge de -2.) Parfois, la charge sera indiquée.  Notez le nom du métal. Puisque tu le sais Fe fer et qu'il a une charge de +3, vous pouvez le faire Fer (III) à mentionner. N'oubliez pas de n'utiliser que des chiffres romains lors de l'écriture du nom et non lors de l'écriture de la formule.
Notez le nom du métal. Puisque tu le sais Fe fer et qu'il a une charge de +3, vous pouvez le faire Fer (III) à mentionner. N'oubliez pas de n'utiliser que des chiffres romains lors de l'écriture du nom et non lors de l'écriture de la formule.  Notez le nom du non-métal. Puisque tu le sais O signifie oxygène, vous pouvez ajouter la terminaison "-ide" et l'appeler "oxyde".
Notez le nom du non-métal. Puisque tu le sais O signifie oxygène, vous pouvez ajouter la terminaison "-ide" et l'appeler "oxyde".  Fusionner le premier et le deuxième nom. Maintenant vous l'avez. Fe2O3 = Oxyde de fer (III).
Fusionner le premier et le deuxième nom. Maintenant vous l'avez. Fe2O3 = Oxyde de fer (III).  Utilisez l'ancienne méthode de dénomination. Dans l'ancienne méthode de dénomination, qui est également utilisée, vous utilisez les noms «ferro» et «ferrique» pour les métaux, au lieu des chiffres romains. Si l'ion métallique a un état d'oxydation inférieur (une charge numérique inférieure, en ignorant le «+» ou «-»), utilisez «ferreux». S'il a une charge plus élevée, vous utilisez "ferri". Fe a l'état inférieur (Fe a l'état supérieur), donc il devient ferreux. Le nom de FeO peut également être écrit comme ferroxyde.
Utilisez l'ancienne méthode de dénomination. Dans l'ancienne méthode de dénomination, qui est également utilisée, vous utilisez les noms «ferro» et «ferrique» pour les métaux, au lieu des chiffres romains. Si l'ion métallique a un état d'oxydation inférieur (une charge numérique inférieure, en ignorant le «+» ou «-»), utilisez «ferreux». S'il a une charge plus élevée, vous utilisez "ferri". Fe a l'état inférieur (Fe a l'état supérieur), donc il devient ferreux. Le nom de FeO peut également être écrit comme ferroxyde. 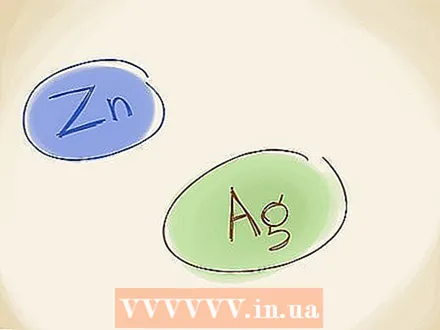 Souvenez-vous des exceptions. Il existe deux métaux de transition qui n'ont pas de charge fixe. Ce sont le zinc (Zn) et l'argent (Ag). Cela signifie que vous n'avez pas besoin d'utiliser les nombres romains ou l'ancienne méthode de dénomination pour décrire ces éléments.
Souvenez-vous des exceptions. Il existe deux métaux de transition qui n'ont pas de charge fixe. Ce sont le zinc (Zn) et l'argent (Ag). Cela signifie que vous n'avez pas besoin d'utiliser les nombres romains ou l'ancienne méthode de dénomination pour décrire ces éléments.
Méthode 3 sur 3: Liaisons avec des ions polyatomiques
 Notez la formule des ions polyatomiques. Cette liaison sera constituée de plus de deux ions. Disons que vous travaillez sur le lien suivant: FeNH4(DONC4)2.
Notez la formule des ions polyatomiques. Cette liaison sera constituée de plus de deux ions. Disons que vous travaillez sur le lien suivant: FeNH4(DONC4)2.  Trouvez la charge du métal. Vous devrez faire des calculs pour le trouver. Tout d'abord, vous savez que c'est du sulfate, ou SO4 ion, a une charge de -2 et qu'il y en a deux, à cause du 2 sous la parenthèse. Donc, 2x -2 = -4. Alors tu sais que NH4, ou l'ion ammoniac, a une charge de +1. Ajoutez -4 et 1 et vous obtenez -3. Cela signifie que l'ion fer, Fe, doit avoir une charge de +3 pour l'égaliser et rendre la liaison neutre.
Trouvez la charge du métal. Vous devrez faire des calculs pour le trouver. Tout d'abord, vous savez que c'est du sulfate, ou SO4 ion, a une charge de -2 et qu'il y en a deux, à cause du 2 sous la parenthèse. Donc, 2x -2 = -4. Alors tu sais que NH4, ou l'ion ammoniac, a une charge de +1. Ajoutez -4 et 1 et vous obtenez -3. Cela signifie que l'ion fer, Fe, doit avoir une charge de +3 pour l'égaliser et rendre la liaison neutre.  Notez le nom du métal. Dans ce cas, vous pouvez faire les deux Fer (III) comme ferri écrire.
Notez le nom du métal. Dans ce cas, vous pouvez faire les deux Fer (III) comme ferri écrire.  Notez le nom des ions non métalliques. Dans ce cas, vous utilisez ammonium et sulfate, ou alors sulfate d'ammonium.
Notez le nom des ions non métalliques. Dans ce cas, vous utilisez ammonium et sulfate, ou alors sulfate d'ammonium.  Combinez le nom du métal avec les noms des non-métaux. Vous pouvez nommer le lien FeNH4(DONC4)2 donner par ou sulfate de fer (III) ammonium ou alors sulfate d'ammonium ferrique écrire.
Combinez le nom du métal avec les noms des non-métaux. Vous pouvez nommer le lien FeNH4(DONC4)2 donner par ou sulfate de fer (III) ammonium ou alors sulfate d'ammonium ferrique écrire.
Conseils
- Si vous allez dans la direction opposée et que vous avez des nombres romains, vous devez faire une "radiographie" de la molécule. Le chiffre romain est la charge du cation.