Auteur:
Lewis Jackson
Date De Création:
5 Peut 2021
Date De Mise À Jour:
1 Juillet 2024

Contenu
Mol est l'unité de mesure standard en chimie, utilisée pour examiner les différents éléments d'un composé. Habituellement, la masse du composé est calculée en grammes (g) et doit être convertie en unités molaires. La transition est assez simple, cependant, il reste quelques étapes importantes à suivre. En utilisant la méthode ci-dessous, vous pouvez facilement convertir des grammes en grains de beauté.
Pas
Partie 1 sur 2: Calculer la masse moléculaire
Préparez les fournitures nécessaires pour résoudre le problème de mathématiques. Lorsque vous aurez tous les outils disponibles, il sera plus facile de résoudre le problème. Ce dont vous avez besoin est:
- Crayon et papier. Le calcul devient plus facile lorsque vous écrivez tout sur papier. Vous devez présenter toutes les étapes pour atteindre le score maximum.
- Tableau périodique des éléments chimiques: utilisé pour déterminer les atomes de masse des éléments.
- Calculatrice de poche: utilisée pour calculer des nombres complexes.

Déterminez les éléments du composé que vous devez convertir en unités molaires. La première étape du calcul de la masse moléculaire consiste à déterminer les éléments qui composent le composé. C'est facile car l'abréviation des éléments ne comporte qu'un à deux caractères.- Si une substance est abrégée par deux lettres, la première lettre sera en majuscule et la deuxième lettre en minuscule. Exemple: Mg est l'abréviation de l'élément magnésium.
- Composés NaHCO3 se compose de quatre éléments: sodium (Na), hydrogène (H), carbone (C) et oxygène (O).
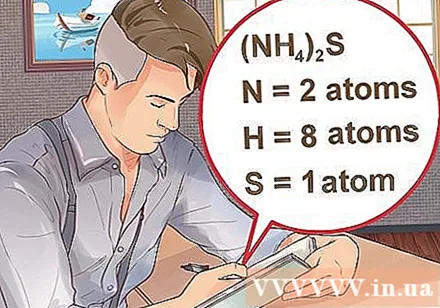
Déterminez le nombre d'atomes pour chaque élément du composé. Vous devez connaître le numéro atomique de chaque substance dans un composé pour calculer la molécule de masse de ce composé. Le petit nombre à côté de l'abréviation de l'élément représente le numéro atomique de l'élément.- Exemple: composé H2O a deux atomes d'hydrogène et un atome d'oxygène.
- Si un composé est écrit entre parenthèses, accompagné d'un petit index, cela signifie que chaque ingrédient entre parenthèses multiplie l'indice. Exemple: composé (NH4)2S se compose de deux atomes N, huit atomes H et un atome S.

Notez le papier atomique cubique pour chaque élément. L'utilisation du tableau périodique est le moyen le plus simple de trouver l'atome cubique d'un élément. Après avoir localisé l'élément dans le tableau périodique, vous verrez la masse atomique juste en dessous de l'icône de l'élément.- Par exemple, l'atome cubique d'oxygène est 15,99.
Calculez la masse moléculaire. La molécule de masse d'une substance est égale au nombre d'atomes de chaque élément multiplié par l'atome de masse de cet élément. Cette quantité est essentielle en conversion gramme en molaire.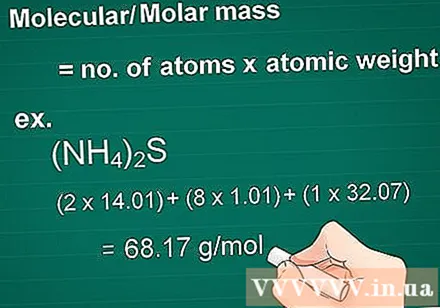
- Tout d'abord, multipliez le numéro atomique de chaque élément du composé par son atome de masse.
- Ensuite, ajoutez les masses des éléments du composé ensemble.
- Exemple: Masse moléculaire d'un composé (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mol.
- La masse moléculaire est également connue sous le nom de masse molaire.
Partie 2 sur 2: Convertir des grammes en mol
Configurez la formule de conversion. Pour trouver le nombre de moles du composé, divisez le nombre de grammes du composé par la masse molaire de ce composé.
- Formule: nombre de moles = masse (grammes) / masse molaire du composé (gramme / mol)
Mettez les nombres dans la formule. Après avoir configuré la bonne formule, l'étape suivante consiste à remplacer les nombres que vous avez calculés dans la formule. Si vous voulez vous assurer que les données sont dans la bonne position, vous pouvez le vérifier en supprimant l'unité. Si après simplicité, l'unité restante est la taupe, alors vous êtes correctement réglé.
Résous l'équation. À l'aide d'une calculatrice, divisez la masse par la molécule cubique de la substance ou du composé. Le quotient sera le nombre de moles de la substance ou du composé que vous recherchez.
- Par exemple, le problème est pour 2 g d'eau (H2O) et vous demander de le convertir en unités molaires. Nous avons la masse molaire de H2O est 18 g / mol. Divisez 2 par 18, vous avez donc 0,1111 mol H2O.
Conseil
- N'oubliez pas d'inclure l'élément ou le nom composé avec les réponses.
- Si on vous demande de présenter un exercice ou un quiz, assurez-vous de montrer clairement vos réponses en encerclant ou en dessinant une case autour des réponses.
De quoi as-tu besoin
- Tableau périodique des produits chimiques
- Crayon
- Papier
- Ordinateur
- Problèmes de chimie