Auteur:
Lewis Jackson
Date De Création:
8 Peut 2021
Date De Mise À Jour:
25 Juin 2024

Contenu
L'équation ionique nette est une partie importante de la chimie car elle ne représente que les particules qui changent lors d'une réaction chimique. Ils sont le plus couramment utilisés dans les réactions d'oxydo-réduction, les réactions métaboliques et les réactions de neutralisation des acides - bases. Il y a trois étapes de base pour écrire une équation ionique nette: équilibrer l'équation moléculaire, la convertir en équation ionique complète (selon la façon dont chaque substance existe en solution), et enfin écrire l'équation ionique nette.
Pas
Partie 1 sur 2: Comprendre les composants de l'équation ionique
Connaître la différence entre les molécules et composés ioniques. La première étape de l'écriture d'une équation ionique nette consiste à déterminer les composés ioniques dans la réaction. Les composés ioniques sont ceux qui dissocient les ions dans une solution aqueuse et ont une charge électrique. Les composés moléculaires sont des composés qui n'ont jamais de charge électrique. Ils sont formés entre deux non-métaux et sont parfois appelés composés covalents.
- Des composés ioniques peuvent être formés entre des métaux et des non-métaux, des métaux et des ions polyatomiques ou plusieurs ions polyatomiques.
- Si vous ne savez pas quel est le composé, vous pouvez rechercher les éléments de ce composé dans le tableau périodique.

Reconnaissez la solubilité d'un composé. Tous les composés ioniques ne sont pas solubles en solution aqueuse, ils ne peuvent donc pas se dissocier en ions. Vous devez identifier la solubilité de chaque composé avant de passer au reste de l'équation. Vous trouverez ci-dessous un résumé des règles de solubilité. Trouvez une feuille de calcul de solubilité pour des informations plus détaillées et des exceptions à ces règles.- Suivez ces règles dans l'ordre indiqué ci-dessous:
- Tous les sels de Na, K et NH4 tout fondre.
- Tous sans sels3, C2H3O2, ClO3et ClO4 tous se dissolvent.
- Tous les sels Ag, Pb et Hg2 tout fondre.
- Tous les sels Cl, Br et I sont solubles.
- Tous les sels de CO3, O, S, OH, PO4, CrO4, Cr2O7, et donc3 sont dissous (sauf dans quelques cas).
- Tous les sels de SO4 tous se dissolvent (sauf dans quelques cas).
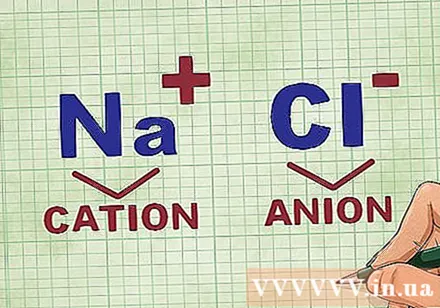
Détermination des cations et des anions dans un composé. Les cations sont les ions positifs d'un composé et sont généralement le métal. L'anion est l'ion négatif du composé et n'est pas métallique. Certains non-métaux peuvent former des cations, mais les métaux forment toujours des cations.- Par exemple, dans NaCl, Na est le cation chargé positivement parce que c'est un métal, et Cl est l'anion chargé négativement parce qu'il est non métallique.

Reconnaissez les ions polyatomiques dans la réaction. Les ions polyatomiques sont des molécules chargées étroitement liées entre elles et qui ne se dissocient pas lors de réactions chimiques. Il est important de reconnaître les ions polyatomiques car ils ont une charge spécifique et ne se dissocient pas. Les ions polyatomiques peuvent avoir une charge positive ou négative.- Si vous étudiez la chimie générale, il est souvent nécessaire de se souvenir de certains ions polyatomiques courants.
- Certains ions polyatomiques courants sont le CO3, NON3, NON2, DONC4, DONC3, ClO4 et ClO3.
- Vous pouvez également trouver de nombreux autres ions dans les livres de chimie ou sur Internet.
Partie 2 sur 2: Écriture d'une équation ionique nette
Équilibrez les équations moléculaires. Avant d'écrire une équation ionique nette, vous devez vous assurer que votre équation moléculaire est équilibrée. Pour équilibrer l'équation, vous ajoutez des coefficients devant le composé de sorte que le numéro atomique de chaque élément soit égal des deux côtés de l'équation.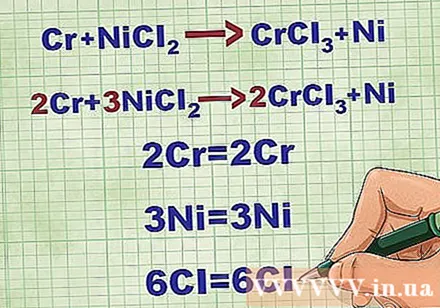
- Écrivez le nombre d'atomes qui composent chaque composé des deux côtés de l'équation.
- Ajoutez un coefficient devant des éléments autres que l'oxygène et l'hydrogène pour équilibrer chaque côté.
- Bilan des atomes d'hydrogène.
- Balance atomique d'oxygène.
- Recomptez le nombre d'atomes de chaque côté de l'équation pour vous assurer qu'ils sont équilibrés.
- Par exemple, Cr + NiCl2 -> CrCl3 + Ni Équilibré à 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
Identifiez l'état du composé dans l'équation. Plusieurs fois dans le problème, il existe des mots-clés pour vous informer de l'état de chaque composé. Il existe plusieurs règles pour aider à déterminer l'état d'un élément ou d'un composé.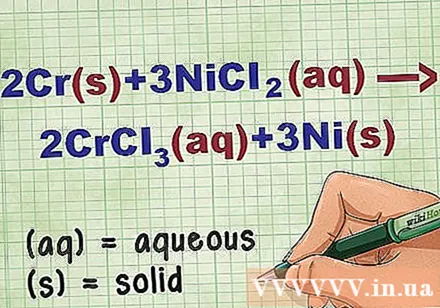
- Si l'état d'un élément n'est pas fourni, utilisez l'état trouvé dans le tableau périodique.
- Si le composé s'appelle une solution, vous pouvez l'écrire comme aqueux ou (jj).
- S'il y a de l'eau dans l'équation, vous devez déterminer si le composé ionique est soluble dans l'eau à l'aide de la feuille de calcul de solubilité. Si la solubilité est élevée, le composé sera aqueux (jj), si la solubilité est faible, le composé sera solide (r).
- Sans eau, le composé ionique est solide (r).
- Si le problème est acide ou basique, alors le composé est aqueux (jj).
- Par exemple, 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Les formes élémentaires de Cr et Ni sont à l'état solide. NiCl2 et CrCl3 les composés ioniques sont solubles, ils sont donc aqueux. Réécrivez l'équation comme suit: 2Cr(r) + 3NiCl2(jj) -> 2CrCl3(jj) + 3Ni(r).
Déterminez quels composés se dissocieront (se dissocieront en cations et anions) en solution. Lorsqu'une substance ou un composé se dissocie, il se dissocie en un ion chargé positivement (cation) et un ion chargé négativement (anion). Ce sont les composants qui seront équilibrés à la fin de l'équation ionique nette.
- Les solides, liquides, gaz, composés moléculaires, composés ioniques à faible solubilité, ions polyatomiques et acides faibles ne se dissocient pas.
- Les composés ioniques ont une solubilité élevée (utilisez le tableau de solubilité) et les acides forts s'ioniseront à 100% (HCl(jj), HBr(jj), SALUT(jj), H2DONC4(jj), HClO4(jj)et HNO3(jj)).
- Notez que bien que les ions polyatomiques ne se dissocient plus, s'ils sont constitutifs de ce composé, ils se dissocient du composé.
Calculez la charge de chaque ion dissocié du composé. N'oubliez pas que les métaux formeront des ions positifs et que les non-métaux formeront des ions négatifs. Utilisez le tableau périodique pour déterminer la charge d'un élément. Vous devez également équilibrer la charge de chaque ion dans le composé.
- Dans cet exemple, NiCl2 dissocié en Ni et Cl tandis que CrCl3 divisé en Cr et Cl.
- Ni a une charge de 2+ parce que Cl a une charge négative de un mais a 2 atomes. Par conséquent, nous devons équilibrer les 2 ions Cl négatifs. Cr a une charge de 3+, nous devons donc équilibrer les 3 ions Cl négatifs.
- N'oubliez pas que les ions polyatomiques ont une charge spécifique.
Notez l'équation ionique complète. Tout ce qui se dissocie ou s'ionise (acides forts) se sépare en deux ions séparés. L'état de la substance demeure (jj), mais assurez-vous que l'équation reste équilibrée.
- Les solides, liquides, gaz, acides faibles et composés ioniques à faible solubilité ne changent pas d'état ou ne se séparent pas en ions. Nous les gardons intacts.
- Les substances moléculaires se dispersent dans la solution de sorte que leur état change en (jj). Trois exceptions ne sont pas devenir (jj) est: CH4(k), C3H8(k), et C8H18(l).
- En continuant avec l'exemple ci-dessus, l'équation ionique complète ressemble à ceci: 2Cr(r) + 3Ni(jj) + 6Cl(jj) -> 2Cr(jj) + 6Cl(jj) + 3Ni(r). Lorsque Cl n'est pas dans un composé, ce n'est pas un bipolaire, donc nous multiplions le facteur par le nombre d'atomes dans le composé pour obtenir 6 ions Cl des deux côtés de l'équation.
Supprimez les ions d'équilibre en annulant les mêmes ions de chaque côté de l'équation. Vous ne pouvez annuler que s'ils sont exactement les mêmes des deux côtés (charge, numéro atomique, etc.). Réécrivez l'équation sans les substances destructibles.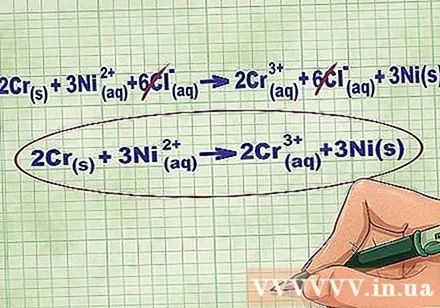
- Après avoir terminé l'exemple, nous avons 6 ions d'équilibre Cl annulables de chaque côté. L'équation ionique nette est 2Cr(r) + 3Ni(jj) -> 2Cr(jj) + 3Ni(r).
- Si vous avez raison, la charge totale côté réactif doit être égale à la charge totale côté produit dans l'équation ionique nette.
Conseil
- Écrivez les états de toutes les substances dans l'équation, sinon vous volonté perdre des points.