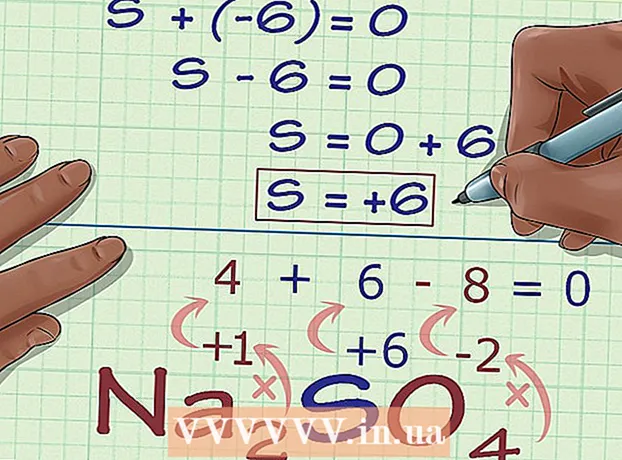
Contenu
- Pas
- Partie 1 sur 2: Détermination de l'état d'oxydation selon les lois de la chimie
- Partie 2 sur 2: Déterminer l'état d'oxydation sans utiliser les lois de la chimie
- Conseils
- De quoi avez-vous besoin
En chimie, les termes « oxydation » et « réduction » désignent des réactions dans lesquelles un atome ou un groupe d'atomes perd ou, respectivement, gagne des électrons. L'état d'oxydation est une valeur numérique attribuée à un ou plusieurs atomes qui caractérise le nombre d'électrons redistribués et montre comment ces électrons sont répartis entre les atomes au cours d'une réaction. La détermination de cette valeur peut être une procédure à la fois simple et assez complexe, en fonction des atomes et des molécules qui les composent. De plus, les atomes de certains éléments peuvent avoir plusieurs états d'oxydation. Heureusement, il existe des règles simples et sans ambiguïté pour déterminer l'état d'oxydation, pour l'utilisation confiante desquelles il suffit de connaître les bases de la chimie et de l'algèbre.
Pas
Partie 1 sur 2: Détermination de l'état d'oxydation selon les lois de la chimie
 1 Déterminez si la substance en question est élémentaire. L'état d'oxydation des atomes en dehors d'un composé chimique est nul. Cette règle est vraie à la fois pour les substances formées d'atomes libres séparés, et pour celles qui se composent de deux molécules ou polyatomiques d'un élément.
1 Déterminez si la substance en question est élémentaire. L'état d'oxydation des atomes en dehors d'un composé chimique est nul. Cette règle est vraie à la fois pour les substances formées d'atomes libres séparés, et pour celles qui se composent de deux molécules ou polyatomiques d'un élément. - Par exemple, Al(s) et Cl2 ont un état d'oxydation de 0, car les deux sont dans un état élémentaire chimiquement non lié.
- Notez que la forme allotropique du soufre S8, ou octacera, malgré sa structure atypique, se caractérise également par un état d'oxydation nul.
 2 Déterminez si la substance en question est composée d'ions. L'état d'oxydation des ions est égal à leur charge. Cela est vrai à la fois pour les ions libres et pour ceux qui font partie de composés chimiques.
2 Déterminez si la substance en question est composée d'ions. L'état d'oxydation des ions est égal à leur charge. Cela est vrai à la fois pour les ions libres et pour ceux qui font partie de composés chimiques. - Par exemple, l'état d'oxydation de l'ion Cl est -1.
- L'état d'oxydation de l'ion Cl dans le composé chimique NaCl est également de -1. Puisque l'ion Na, par définition, a une charge de +1, nous concluons que la charge de l'ion Cl est -1, et donc son état d'oxydation est -1.
 3 Veuillez noter que les ions métalliques peuvent avoir plusieurs états d'oxydation. Les atomes de nombreux éléments métalliques peuvent s'ioniser à des quantités différentes. Par exemple, la charge ionique d'un métal tel que le fer (Fe) est de +2 ou +3. La charge des ions métalliques (et leur état d'oxydation) peut être déterminée par les charges des ions d'autres éléments avec lesquels ce métal fait partie d'un composé chimique ; dans le texte, cette charge est désignée par des chiffres romains : par exemple, le fer (III) a un état d'oxydation de +3.
3 Veuillez noter que les ions métalliques peuvent avoir plusieurs états d'oxydation. Les atomes de nombreux éléments métalliques peuvent s'ioniser à des quantités différentes. Par exemple, la charge ionique d'un métal tel que le fer (Fe) est de +2 ou +3. La charge des ions métalliques (et leur état d'oxydation) peut être déterminée par les charges des ions d'autres éléments avec lesquels ce métal fait partie d'un composé chimique ; dans le texte, cette charge est désignée par des chiffres romains : par exemple, le fer (III) a un état d'oxydation de +3. - A titre d'exemple, considérons un composé contenant un ion aluminium. Charge totale du composé AlCl3 est zéro.Puisque nous savons que les ions Cl ont une charge de -1 et que le composé en contient 3, pour la neutralité générale de la substance en question, l'ion Al doit avoir une charge de +3. Ainsi, dans ce cas, l'état d'oxydation de l'aluminium est de +3.
 4 L'état d'oxydation de l'oxygène est de -2 (à quelques exceptions près). Dans presque tous les cas, les atomes d'oxygène ont un état d'oxydation de -2. Il existe plusieurs exceptions à cette règle :
4 L'état d'oxydation de l'oxygène est de -2 (à quelques exceptions près). Dans presque tous les cas, les atomes d'oxygène ont un état d'oxydation de -2. Il existe plusieurs exceptions à cette règle : - Si l'oxygène est à l'état élémentaire (O2), son état d'oxydation est 0, comme dans le cas d'autres substances élémentaires.
- Si l'oxygène fait partie de peroxyde, son état d'oxydation est -1. Les peroxydes sont un groupe de composés contenant une simple liaison oxygène-oxygène (c'est-à-dire l'anion peroxyde O2). Par exemple, dans la composition du H2O2 (peroxyde d'hydrogène) l'oxygène a une charge et un état d'oxydation de -1.
- Lorsqu'il est combiné avec du fluor, l'oxygène a un état d'oxydation de +2, lisez la règle pour le fluor ci-dessous.
 5 L'hydrogène a un état d'oxydation de +1, à quelques exceptions près. Comme pour l'oxygène, il y a aussi des exceptions. En règle générale, l'état d'oxydation de l'hydrogène est +1 (s'il n'est pas à l'état élémentaire H2). Cependant, dans les composés appelés hydrures, l'état d'oxydation de l'hydrogène est de -1.
5 L'hydrogène a un état d'oxydation de +1, à quelques exceptions près. Comme pour l'oxygène, il y a aussi des exceptions. En règle générale, l'état d'oxydation de l'hydrogène est +1 (s'il n'est pas à l'état élémentaire H2). Cependant, dans les composés appelés hydrures, l'état d'oxydation de l'hydrogène est de -1. - Par exemple, en H2O L'état d'oxydation de l'hydrogène est +1 car l'atome d'oxygène a une charge de -2, et deux charges +1 sont nécessaires pour la neutralité globale. Néanmoins, dans la composition de l'hydrure de sodium, l'état d'oxydation de l'hydrogène est déjà -1, puisque l'ion Na porte une charge de +1, et pour l'électroneutralité générale, la charge de l'atome d'hydrogène (et donc son état d'oxydation) devrait être -1.
 6 Fluor toujours a un état d'oxydation de -1. Comme déjà noté, l'état d'oxydation de certains éléments (ions métalliques, atomes d'oxygène dans les peroxydes, etc.) peut varier en fonction d'un certain nombre de facteurs. L'état d'oxydation du fluor, cependant, est invariablement de -1. Cela est dû au fait que cet élément a la plus grande électronégativité - en d'autres termes, les atomes de fluor sont les moins disposés à se séparer de leurs propres électrons et attirent le plus activement les électrons étrangers. Ainsi, leur charge reste inchangée.
6 Fluor toujours a un état d'oxydation de -1. Comme déjà noté, l'état d'oxydation de certains éléments (ions métalliques, atomes d'oxygène dans les peroxydes, etc.) peut varier en fonction d'un certain nombre de facteurs. L'état d'oxydation du fluor, cependant, est invariablement de -1. Cela est dû au fait que cet élément a la plus grande électronégativité - en d'autres termes, les atomes de fluor sont les moins disposés à se séparer de leurs propres électrons et attirent le plus activement les électrons étrangers. Ainsi, leur charge reste inchangée.  7 La somme des états d'oxydation d'un composé est égale à sa charge. Les états d'oxydation de tous les atomes qui composent un composé chimique devraient s'additionner à la charge de ce composé. Par exemple, si un composé est neutre, la somme des états d'oxydation de tous ses atomes doit être nulle ; si le composé est un ion polyatomique avec une charge de -1, la somme des états d'oxydation est de -1, et ainsi de suite.
7 La somme des états d'oxydation d'un composé est égale à sa charge. Les états d'oxydation de tous les atomes qui composent un composé chimique devraient s'additionner à la charge de ce composé. Par exemple, si un composé est neutre, la somme des états d'oxydation de tous ses atomes doit être nulle ; si le composé est un ion polyatomique avec une charge de -1, la somme des états d'oxydation est de -1, et ainsi de suite. - C'est une bonne méthode de test - si la somme des états d'oxydation n'est pas égale à la charge totale du composé, alors vous vous trompez quelque part.
Partie 2 sur 2: Déterminer l'état d'oxydation sans utiliser les lois de la chimie
 1 Trouvez des atomes qui n'ont pas de règles strictes concernant leur état d'oxydation. Pour certains éléments, il n'y a pas de règles fermement établies pour trouver l'état d'oxydation. Si un atome ne correspond à aucune des règles énumérées ci-dessus et que vous ne connaissez pas sa charge (par exemple, l'atome fait partie d'un complexe et sa charge n'est pas spécifiée), vous pouvez déterminer l'état d'oxydation d'un tel atome par exclusion. Tout d'abord, déterminez la charge de tous les autres atomes du composé, puis, à partir de la charge totale connue du composé, calculez l'état d'oxydation de cet atome.
1 Trouvez des atomes qui n'ont pas de règles strictes concernant leur état d'oxydation. Pour certains éléments, il n'y a pas de règles fermement établies pour trouver l'état d'oxydation. Si un atome ne correspond à aucune des règles énumérées ci-dessus et que vous ne connaissez pas sa charge (par exemple, l'atome fait partie d'un complexe et sa charge n'est pas spécifiée), vous pouvez déterminer l'état d'oxydation d'un tel atome par exclusion. Tout d'abord, déterminez la charge de tous les autres atomes du composé, puis, à partir de la charge totale connue du composé, calculez l'état d'oxydation de cet atome. - Par exemple, dans le composé Na2ALORS4 la charge de l'atome de soufre (S) est inconnue - nous savons seulement qu'elle n'est pas nulle, puisque le soufre n'est pas à l'état élémentaire. Ce composé est un bon exemple pour illustrer la méthode algébrique de détermination de l'état d'oxydation.
 2 Trouvez les états d'oxydation des éléments restants dans le composé. En utilisant les règles décrites ci-dessus, déterminez les états d'oxydation des atomes restants du composé. N'oubliez pas les exceptions à la règle pour O, H, etc.
2 Trouvez les états d'oxydation des éléments restants dans le composé. En utilisant les règles décrites ci-dessus, déterminez les états d'oxydation des atomes restants du composé. N'oubliez pas les exceptions à la règle pour O, H, etc. - Pour Na2ALORS4, en utilisant nos règles, nous trouvons que la charge (et donc l'état d'oxydation) de l'ion Na est de +1, et pour chacun des atomes d'oxygène, elle est de -2.
 3 Multipliez le nombre d'atomes par leur état d'oxydation. Maintenant que nous connaissons les états d'oxydation de tous les atomes sauf un, il faut tenir compte du fait qu'il peut y avoir plusieurs atomes de certains éléments. Multipliez le nombre d'atomes de chaque élément (il est indiqué dans la formule chimique du composé en indice après le symbole de l'élément) par son état d'oxydation.
3 Multipliez le nombre d'atomes par leur état d'oxydation. Maintenant que nous connaissons les états d'oxydation de tous les atomes sauf un, il faut tenir compte du fait qu'il peut y avoir plusieurs atomes de certains éléments. Multipliez le nombre d'atomes de chaque élément (il est indiqué dans la formule chimique du composé en indice après le symbole de l'élément) par son état d'oxydation. - à Na2ALORS4 nous avons 2 atomes Na et 4 atomes O. Ainsi, en multipliant 2 × +1, nous obtenons l'état d'oxydation de tous les atomes Na (2), et en multipliant 4 × -2 - l'état d'oxydation des atomes O (-8).
 4 Additionnez les résultats précédents. En résumant les résultats de la multiplication, nous obtenons l'état d'oxydation du composé sans pour autant en tenant compte de la contribution de l'atome recherché.
4 Additionnez les résultats précédents. En résumant les résultats de la multiplication, nous obtenons l'état d'oxydation du composé sans pour autant en tenant compte de la contribution de l'atome recherché. - Dans notre exemple, pour Na2ALORS4 nous ajoutons 2 et -8 et obtenons -6.
 5 Trouvez l'état d'oxydation inconnu à partir de la charge du composé. Vous disposez maintenant de toutes les données pour calculer facilement l'état d'oxydation souhaité. Écrivez une équation, sur le côté gauche de laquelle il y aura la somme du nombre obtenu à l'étape de calcul précédente et l'état d'oxydation inconnu, et sur le côté droit de la charge totale du composé. En d'autres termes, (Somme des états d'oxydation connus) + (état d'oxydation souhaité) = (charge d'un composé).
5 Trouvez l'état d'oxydation inconnu à partir de la charge du composé. Vous disposez maintenant de toutes les données pour calculer facilement l'état d'oxydation souhaité. Écrivez une équation, sur le côté gauche de laquelle il y aura la somme du nombre obtenu à l'étape de calcul précédente et l'état d'oxydation inconnu, et sur le côté droit de la charge totale du composé. En d'autres termes, (Somme des états d'oxydation connus) + (état d'oxydation souhaité) = (charge d'un composé).- Dans notre cas, Na2ALORS4 la solution ressemble à ceci :
- (Somme des états d'oxydation connus) + (état d'oxydation souhaité) = (charge du composé)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2ALORS4 le soufre a un état d'oxydation 6.
- Dans notre cas, Na2ALORS4 la solution ressemble à ceci :
Conseils
- Dans les composés, la somme de tous les états d'oxydation doit être égale à la charge. Par exemple, si le composé est un ion diatomique, la somme des états d'oxydation des atomes doit être égale à la charge ionique totale.
- Il est très utile de pouvoir utiliser le tableau périodique et de savoir où se trouvent les éléments métalliques et non métalliques dans celui-ci.
- L'état d'oxydation des atomes sous forme élémentaire est toujours nul. L'état d'oxydation d'un seul ion est égal à sa charge. Les éléments du groupe 1A du tableau périodique, tels que l'hydrogène, le lithium, le sodium, sous forme élémentaire ont un état d'oxydation +1 ; L'état d'oxydation des métaux du groupe 2A, tels que le magnésium et le calcium, est de +2 sous forme élémentaire. L'oxygène et l'hydrogène, selon le type de liaison chimique, peuvent avoir 2 états d'oxydation différents.
De quoi avez-vous besoin
- Tableau périodique des éléments
- Accès Internet ou ouvrages de référence en chimie
- Une feuille de papier, un stylo ou un crayon
- Calculatrice