Auteur:
Frank Hunt
Date De Création:
13 Mars 2021
Date De Mise À Jour:
1 Juillet 2024

Contenu
- Avancer d'un pas
- Méthode 1 sur 3: Utilisation d'un pH-mètre
- Méthode 2 sur 3: avec du papier de tournesol
- Méthode 3 sur 3: Comprendre le pH
Il est important de mesurer le pH - le degré d'acidité ou d'alcalinité - de l'eau. L'eau est utilisée par les plantes et les animaux dont nous dépendons, et nous la buvons tous les jours. La valeur du pH de l'eau peut être une indication d'une contamination possible, de sorte que la mesure du pH de l'eau peut être une précaution de santé publique importante.
Avancer d'un pas
Méthode 1 sur 3: Utilisation d'un pH-mètre
 Calibrez la sonde et le multimètre conformément aux instructions d'usine. Vous devrez peut-être étalonner le compteur à l'aide d'une substance dont le pH est connu. Le compteur peut être ajusté en fonction de cette substance. Si vous prévoyez de tester l'eau en dehors d'un laboratoire, il est recommandé d'effectuer cet étalonnage quelques heures avant le test sur le terrain.
Calibrez la sonde et le multimètre conformément aux instructions d'usine. Vous devrez peut-être étalonner le compteur à l'aide d'une substance dont le pH est connu. Le compteur peut être ajusté en fonction de cette substance. Si vous prévoyez de tester l'eau en dehors d'un laboratoire, il est recommandé d'effectuer cet étalonnage quelques heures avant le test sur le terrain. - Rincez la sonde à l'eau claire avant utilisation. Sécher avec un chiffon propre.
 Prélevez un échantillon d'eau et versez-le dans un récipient propre.
Prélevez un échantillon d'eau et versez-le dans un récipient propre.- L'eau doit être suffisamment profonde pour submerger la pointe de l'électrode.
- Laissez l'échantillon pendant un moment pour permettre à la température de se stabiliser.
- Mesurez la température de l'échantillon avec un thermomètre.
 Ajustez le compteur avec la température de l'échantillon. La sensibilité de la sonde est affectée par la température de l'eau, de sorte que la mesure ne peut être précise que si vous entrez les données de température.
Ajustez le compteur avec la température de l'échantillon. La sensibilité de la sonde est affectée par la température de l'eau, de sorte que la mesure ne peut être précise que si vous entrez les données de température.  Placer la sonde dans l'échantillon. Attendez que le compteur atteigne l'équilibre. Le compteur est dans un état stable lorsque la lecture est stable.
Placer la sonde dans l'échantillon. Attendez que le compteur atteigne l'équilibre. Le compteur est dans un état stable lorsque la lecture est stable.  Lisez la mesure du pH de l'échantillon. Le pH-mètre donne le résultat sur une échelle de 0 à 14. Si l'eau est pure, la valeur est d'environ 7. Notez vos résultats.
Lisez la mesure du pH de l'échantillon. Le pH-mètre donne le résultat sur une échelle de 0 à 14. Si l'eau est pure, la valeur est d'environ 7. Notez vos résultats.
Méthode 2 sur 3: avec du papier de tournesol
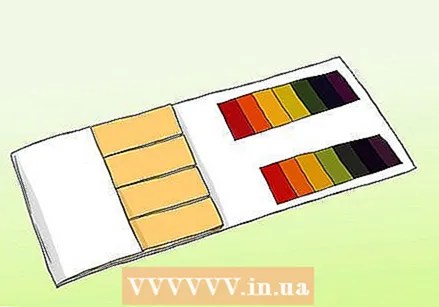 Apprenez la différence entre le papier pH et le papier tournesol. Vous pouvez utiliser du papier pH pour obtenir une lecture précise d'un échantillon. Cependant, le papier pH ne doit pas être confondu avec le papier de tournesol ordinaire. Les deux peuvent être utilisés pour tester les acides et les bases, mais ils diffèrent sur des points importants.
Apprenez la différence entre le papier pH et le papier tournesol. Vous pouvez utiliser du papier pH pour obtenir une lecture précise d'un échantillon. Cependant, le papier pH ne doit pas être confondu avec le papier de tournesol ordinaire. Les deux peuvent être utilisés pour tester les acides et les bases, mais ils diffèrent sur des points importants. - Les bandelettes de pH contiennent une série de barres indicatrices qui changent de couleur lorsqu'elles sont exposées à une solution. La force des acides et des bases sur chaque barre diffère. Après le changement, le motif de couleur peut être comparé aux échantillons fournis avec le kit.
- Le papier de tournesol est une bande de papier qui contient un acide ou une base (alcaline). Les rayures les plus courantes sont le rouge (avec un acide qui réagit avec les bases) et le bleu (avec une base qui réagit avec les acides). Les bandes rouges deviennent bleues si la substance est alcaline et les bandes bleues deviennent rouges si la substance est acide. Les papiers de tournesol peuvent être utilisés comme test rapide et facile, mais les variétés les moins chères ne donnent pas toujours une mesure précise de la force de la solution.
 Prélevez un échantillon d'eau et versez-le dans un récipient propre. L'eau doit être suffisamment profonde pour submerger la bande.
Prélevez un échantillon d'eau et versez-le dans un récipient propre. L'eau doit être suffisamment profonde pour submerger la bande.  Trempez une bandelette de test dans l'échantillon. Une exposition de quelques secondes suffit. Les barres indicatrices sur le papier changeront de couleur après quelques instants.
Trempez une bandelette de test dans l'échantillon. Une exposition de quelques secondes suffit. Les barres indicatrices sur le papier changeront de couleur après quelques instants.  Comparez l'extrémité de la bandelette de test avec le nuancier fourni avec le papier. La ou les couleurs de la carte doivent correspondre à la ou aux couleurs de la bandelette de test. La carte des couleurs relie ensuite les modèles de couleur aux niveaux de pH.
Comparez l'extrémité de la bandelette de test avec le nuancier fourni avec le papier. La ou les couleurs de la carte doivent correspondre à la ou aux couleurs de la bandelette de test. La carte des couleurs relie ensuite les modèles de couleur aux niveaux de pH.
Méthode 3 sur 3: Comprendre le pH
 Apprenez comment les acides et les bases sont définis. L'acidité et l'alcalinité (le terme utilisé pour décrire les bases) sont toutes deux définies par les ions hydrogène qu'elles donnent ou absorbent. Un acide est une substance qui donne (ou «donne») des ions hydrogène, et une base est une substance qui absorbe des ions hydrogène supplémentaires.
Apprenez comment les acides et les bases sont définis. L'acidité et l'alcalinité (le terme utilisé pour décrire les bases) sont toutes deux définies par les ions hydrogène qu'elles donnent ou absorbent. Un acide est une substance qui donne (ou «donne») des ions hydrogène, et une base est une substance qui absorbe des ions hydrogène supplémentaires.  Comprenez l'échelle de pH. L'indice de pH est utilisé pour mesurer le degré d'acidité ou d'alcalinité des substances solubles dans l'eau. L'eau contient normalement la même quantité d'ions hydroxyde (OH-) et d'ions hydronium (H3O +). Le rapport des ions hydroxyde et hydronium change lorsqu'une substance acide ou alcaline est ajoutée à l'eau.
Comprenez l'échelle de pH. L'indice de pH est utilisé pour mesurer le degré d'acidité ou d'alcalinité des substances solubles dans l'eau. L'eau contient normalement la même quantité d'ions hydroxyde (OH-) et d'ions hydronium (H3O +). Le rapport des ions hydroxyde et hydronium change lorsqu'une substance acide ou alcaline est ajoutée à l'eau. - Il est généralement considéré comme une échelle allant de 0 à 14 (bien que les substances puissent très bien tomber en dehors de cette plage). Les substances neutres ont un score d'environ 7, les substances acides sont inférieures à 7 et les substances alcalines supérieures à 7.
- L'échelle de pH est logarithmique, ce qui signifie que les différences entières représentent une différence de dix fois en termes d'acidité ou d'alcalinité. Par exemple, une substance avec un pH de 2 est dix fois plus acide qu'une substance avec un pH de 3, et 100 fois plus acide qu'une substance avec un pH de 4. L'échelle fonctionne de la même manière avec les substances alcalines, avec tout L'entier représente une différence décuplée.
 Découvrez pourquoi nous testons le pH de l'eau. L'eau pure a un pH de 7, mais l'eau du robinet hollandaise a généralement un pH compris entre 7,5 et 8,3. L'eau très acide (eau avec un pH faible) est plus susceptible de dissoudre les produits chimiques toxiques. Ceux-ci peuvent polluer l'eau et la rendre impropre à la consommation.
Découvrez pourquoi nous testons le pH de l'eau. L'eau pure a un pH de 7, mais l'eau du robinet hollandaise a généralement un pH compris entre 7,5 et 8,3. L'eau très acide (eau avec un pH faible) est plus susceptible de dissoudre les produits chimiques toxiques. Ceux-ci peuvent polluer l'eau et la rendre impropre à la consommation. - En général, il est conseillé de tester le pH sur place. Si vous prélevez un échantillon d'eau pour la recherche en laboratoire, le dioxyde de carbone (CO2) de l'air peut se dissoudre dans l'eau. Le dioxyde de carbone dissous réagit avec les ions dans l'eau et augmente l'acidité dans les solutions basiques ou neutres. Pour éviter la contamination par le dioxyde de carbone, l'eau doit être testée dans les deux heures suivant la collecte.



