Auteur:
Virginia Floyd
Date De Création:
6 Août 2021
Date De Mise À Jour:
1 Juillet 2024
Contenu
- Pas
- Méthode 1 sur 3: Les bases
- Méthode 2 sur 3: Détermination du type de liaison par électronégativité
- Méthode 3 sur 3: Calcul de l'électronégativité de Mulliken
- Conseils
En chimie, l'électronégativité est la capacité des atomes à attirer vers eux des électrons d'autres atomes. Un atome à forte électronégativité attire fortement les électrons et un atome à faible électronégativité attire faiblement les électrons. Les valeurs d'électronégativité sont utilisées pour prédire le comportement de divers atomes dans les composés chimiques.
Pas
Méthode 1 sur 3: Les bases
 1 Liaisons chimiques. De telles liaisons surviennent lorsque les électrons des atomes interagissent les uns avec les autres, c'est-à-dire que deux électrons (un de chaque atome) deviennent communs.
1 Liaisons chimiques. De telles liaisons surviennent lorsque les électrons des atomes interagissent les uns avec les autres, c'est-à-dire que deux électrons (un de chaque atome) deviennent communs. - Une description des raisons de l'interaction des électrons dans les atomes dépasse le cadre de cet article.Pour plus d'informations à ce sujet, lisez, par exemple, cet article.
 2 Effet de l'électronégativité. Lorsque deux atomes s'attirent mutuellement des électrons, la force d'attraction n'est pas la même. Un atome avec une électronégativité plus élevée attire deux électrons plus fortement. Un atome à très haute électronégativité attire les électrons avec une force telle qu'on ne parle plus d'électrons partagés.
2 Effet de l'électronégativité. Lorsque deux atomes s'attirent mutuellement des électrons, la force d'attraction n'est pas la même. Un atome avec une électronégativité plus élevée attire deux électrons plus fortement. Un atome à très haute électronégativité attire les électrons avec une force telle qu'on ne parle plus d'électrons partagés. - Par exemple, dans la molécule de NaCl (chlorure de sodium, sel commun), l'atome de chlore a une électronégativité assez élevée et l'atome de sodium est plutôt faible. donc des électrons sont attirés par l'atome de chlore et repousser les atomes de sodium.
 3 Tableau d'électronégativité. Ce tableau comprend des éléments chimiques disposés de la même manière que dans le tableau périodique, mais pour chaque élément l'électronégativité de ses atomes est donnée. Un tel tableau peut être trouvé dans les manuels de chimie, les documents de référence et sur le Web.
3 Tableau d'électronégativité. Ce tableau comprend des éléments chimiques disposés de la même manière que dans le tableau périodique, mais pour chaque élément l'électronégativité de ses atomes est donnée. Un tel tableau peut être trouvé dans les manuels de chimie, les documents de référence et sur le Web. - Vous trouverez ici une excellente table d'électronégativité. Notez qu'il utilise l'échelle d'électronégativité de Pauling, qui est la plus courante. Cependant, il existe d'autres façons de calculer l'électronégativité, dont l'une sera discutée ci-dessous.
 4 Tendances de l'électronégativité. Si vous n'avez pas de table d'électronégativité à portée de main, vous pouvez estimer l'électronégativité d'un atome par l'emplacement d'un élément dans le tableau périodique.
4 Tendances de l'électronégativité. Si vous n'avez pas de table d'électronégativité à portée de main, vous pouvez estimer l'électronégativité d'un atome par l'emplacement d'un élément dans le tableau périodique. - Comment À droite l'élément est localisé, le Suite l'électronégativité de son atome.
- Comment plus haute l'élément est localisé, le Suite l'électronégativité de son atome.
- Ainsi, les atomes des éléments situés dans le coin supérieur droit du tableau périodique ont les électronégativités les plus élevées et les atomes des éléments situés dans le coin inférieur gauche ont les plus faibles.
- Dans notre exemple NaCl, nous pouvons dire que le chlore a une électronégativité plus élevée que le sodium, car le chlore est situé à droite du sodium.
Méthode 2 sur 3: Détermination du type de liaison par électronégativité
 1 Calculez la différence entre les électronégativités de deux atomes pour comprendre les caractéristiques de la liaison entre eux. Pour ce faire, soustrayez la plus petite électronégativité de la plus grande.
1 Calculez la différence entre les électronégativités de deux atomes pour comprendre les caractéristiques de la liaison entre eux. Pour ce faire, soustrayez la plus petite électronégativité de la plus grande. - Par exemple, considérons la molécule HF. Soustraire l'électronégativité de l'hydrogène (2.1) de l'électronégativité du fluor (4.0): 4.0 - 2.1 = 1,9.
 2 Si la différence est inférieure à 0,5, alors la liaison est non polaire covalente, dans laquelle les électrons sont attirés avec presque la même force. De telles liaisons se forment entre deux atomes identiques. Les connexions non polaires sont généralement très difficiles à rompre. En effet, les atomes partagent des électrons, ce qui rend leur liaison stable. Il faut beaucoup d'énergie pour le détruire.
2 Si la différence est inférieure à 0,5, alors la liaison est non polaire covalente, dans laquelle les électrons sont attirés avec presque la même force. De telles liaisons se forment entre deux atomes identiques. Les connexions non polaires sont généralement très difficiles à rompre. En effet, les atomes partagent des électrons, ce qui rend leur liaison stable. Il faut beaucoup d'énergie pour le détruire. - Par exemple, la molécule O2 a ce type de connexion. Puisque deux atomes d'oxygène ont la même électronégativité, la différence entre eux est de 0.
 3 Si la différence se situe dans la plage de 0,5 à 1,6, alors la liaison est polaire covalente. Dans ce cas, l'un des deux atomes attire plus fortement les électrons et acquiert donc une charge partielle négative, et l'autre une charge partielle positive. Ce déséquilibre de charge permet à la molécule de participer à certaines réactions.
3 Si la différence se situe dans la plage de 0,5 à 1,6, alors la liaison est polaire covalente. Dans ce cas, l'un des deux atomes attire plus fortement les électrons et acquiert donc une charge partielle négative, et l'autre une charge partielle positive. Ce déséquilibre de charge permet à la molécule de participer à certaines réactions. - Par exemple, la molécule H2O (eau) a ce type de liaison. L'atome O est plus électronégatif que deux atomes H, donc l'oxygène attire les électrons plus fortement et acquiert une charge négative partielle, et l'hydrogène - une charge positive partielle.
 4 Si la différence est supérieure à 2,0, alors la liaison est ionique. Il s'agit d'une liaison dans laquelle la paire d'électrons commune passe principalement à un atome avec une électronégativité plus élevée, qui acquiert une charge négative, et un atome avec une électronégativité plus faible acquiert une charge positive. Les molécules avec de telles liaisons réagissent bien avec d'autres atomes et peuvent même être détruites par des atomes polaires.
4 Si la différence est supérieure à 2,0, alors la liaison est ionique. Il s'agit d'une liaison dans laquelle la paire d'électrons commune passe principalement à un atome avec une électronégativité plus élevée, qui acquiert une charge négative, et un atome avec une électronégativité plus faible acquiert une charge positive. Les molécules avec de telles liaisons réagissent bien avec d'autres atomes et peuvent même être détruites par des atomes polaires. - Par exemple, la molécule de NaCl (chlorure de sodium) possède ce type de liaison.L'atome de chlore est tellement électronégatif qu'il attire les deux électrons vers lui et acquiert une charge négative, et l'atome de sodium acquiert une charge positive.
- NaCl peut être détruit par une molécule polaire telle que H2O (eau). Dans une molécule d'eau, le côté hydrogène de la molécule est positif et le côté oxygène est négatif. Si vous mélangez du sel avec de l'eau, les molécules d'eau décomposent les molécules de sel, provoquant leur dissolution.
 5 Si la différence se situe entre 1,6 et 2,0, recherchez le métal. Si un atome de métal est présent dans une molécule, alors la liaison est ionique. S'il n'y a pas d'atomes de métal dans la molécule, alors la liaison est covalente polaire.
5 Si la différence se situe entre 1,6 et 2,0, recherchez le métal. Si un atome de métal est présent dans une molécule, alors la liaison est ionique. S'il n'y a pas d'atomes de métal dans la molécule, alors la liaison est covalente polaire. - Les métaux sont situés à gauche et au centre du tableau périodique. Dans ce tableau, les métaux sont mis en évidence.
- Dans notre exemple HF, la différence entre les électronégativités se situe dans cette plage. Puisque H et F ne sont pas des métaux, la liaison Covalent polaire.
Méthode 3 sur 3: Calcul de l'électronégativité de Mulliken
 1 Trouver la première énergie d'ionisation d'un atome. L'échelle d'électronégativité de Mulliken est légèrement différente de l'échelle de Pauling mentionnée ci-dessus. La première énergie d'ionisation est nécessaire pour éliminer un atome d'un électron.
1 Trouver la première énergie d'ionisation d'un atome. L'échelle d'électronégativité de Mulliken est légèrement différente de l'échelle de Pauling mentionnée ci-dessus. La première énergie d'ionisation est nécessaire pour éliminer un atome d'un électron. - La signification d'une telle énergie peut être trouvée dans des ouvrages de référence en chimie ou sur le net, par exemple ici.
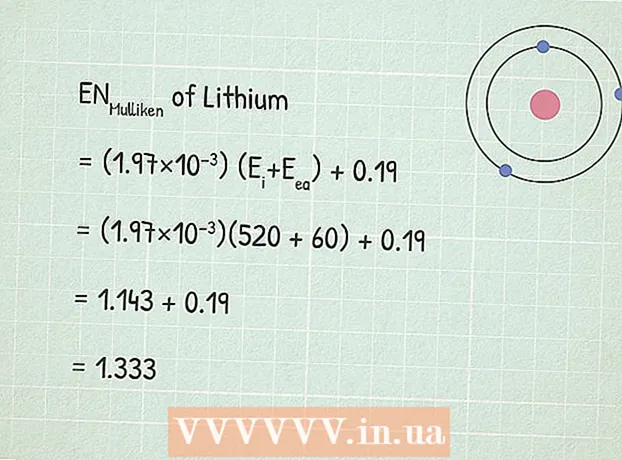
- A titre d'exemple, trouvons l'électronégativité du lithium (Li). Sa première énergie d'ionisation est 520 kJ/mol.
 2 Trouver l'énergie d'affinité pour un électron. C'est l'énergie libérée lors du processus d'attachement d'un électron à un atome. La signification d'une telle énergie peut être trouvée dans des ouvrages de référence en chimie ou sur le net, par exemple ici.
2 Trouver l'énergie d'affinité pour un électron. C'est l'énergie libérée lors du processus d'attachement d'un électron à un atome. La signification d'une telle énergie peut être trouvée dans des ouvrages de référence en chimie ou sur le net, par exemple ici. - L'énergie d'affinité électronique du lithium est 60 kJ/mol.
 3 Utilisez l'équation d'électronégativité de Mulliken :RUMulliken = (1,97 × 10) (Eje+ Ech) + 0,19.
3 Utilisez l'équation d'électronégativité de Mulliken :RUMulliken = (1,97 × 10) (Eje+ Ech) + 0,19. - Dans notre exemple :
- RUMulliken = (1,97 × 10) (Eje+ Ech) + 0,19
- RUMulliken = (1,97×10)(520 + 60) + 0,19
- RUMulliken = 1,143 + 0,19 = 1,333
- Dans notre exemple :
Conseils
- En plus des échelles de Pauling et Mulliken, il existe des échelles d'électronégativité selon Allred-Rochow, Sanderson, Allen. Ils ont tous leurs propres formules pour calculer l'électronégativité (certaines d'entre elles sont assez compliquées).
- L'électronégativité n'a pas d'unité de mesure.



